Гидрид железа(II) или гидроксид железа — неорганическое соединение с формулой Fe(OH)2. Он получается, когда соли железа(II) из такого соединения, как сульфат железа(II), обрабатываются гидроксид-ионами. Гидроксид железа(II) — это белое твердое вещество, но даже следы кислорода придают ему зеленоватый оттенок. Окисленное воздухом твердое вещество иногда называют «зеленой ржавчиной».
Приготовление и реакции
Гидроксид железа(II) плохо растворим в воде (1,43 × 10−3 г/л), или 1,59 × 10−5 моль/л. Он выпадает в осадок в результате реакции солей железа(II) и гидроксида:
- FeSO4 + 2 NaOH → Fe(OH)2 + Na2SO4
Если раствор не дезоксигенирован и железо не полностью восстановлено до Fe(II), осадок может иметь цвет от зеленого до красновато-коричневого в зависимости от содержания железа(III). Ионы железа(II) легко замещаются ионами железа(III), образующимися при его постепенном окислении.
Он также легко образуется как побочный продукт других реакций, например, при синтезе сидерита, карбоната железа (FeCO3), если условия роста кристаллов контролируются несовершенно.
Состав

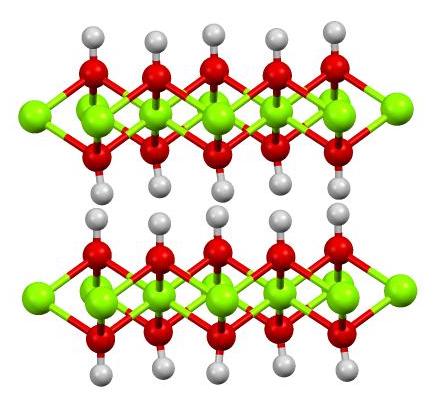
Fe(OH)2 принимает структуру брусита, т. е. расположение атомов в кристалле такое же, как расположение атомов в Mg(OH)2. Центры Fe(II) связаны с шестью гидроксидными лигандами. Каждый гидроксидный лиганд соединяется с тремя сайтами Fe(II). Связи O-H перпендикулярны плоскостям, определяемым атомами кислорода, выступая выше и ниже этих слоев.
Реакции
В анаэробных условиях гидроксид железа(II) может окисляться протонами воды с образованием магнетита (оксида железа(II,III)) и молекулярного водорода. Этот процесс описывается реакцией Шикорра:
- 3 Fe(OH)2 → Fe3O4 + H2 + 2 H2O
Такие анионы, как селенит и селенат, легко адсорбируются на положительно заряженной поверхности гидроксида железа(II), где они впоследствии восстанавливаются Fe2+. Образующиеся продукты плохо растворимы (Se0, FeSe или FeSe2).
Естественное явление
Железо, растворенное в грунтовых водах, находится в восстановленной форме железа II. Если эта грунтовая вода контактирует с кислородом на поверхности, например, в природных источниках, железо II окисляется до железа III и образует нерастворимые гидроксиды в воде. Природным аналогом соединения гидроксида железа(II) является очень редкий минерал амакинит,
(Fe,Mg)(OH)2.
Приложение
Гидроксид железа(II) также исследовался как агент для удаления токсичных ионов селената и селенита из водных систем, таких как водно-болотные угодья. Гидроксид железа(II) восстанавливает эти ионы до элементарного селена, который нерастворим в воде и выпадает в осадок.
В щелочном растворе гидроксид железа(II) является электрохимически активным материалом отрицательного электрода никель-железного аккумулятора.


